Daya Hantar Listrik Larutan
Disusun oleh :
X aks
Kata Pengantar
Yang pertama selayaknya kita ucapkan puji syukur kita ke hadirat Tuhan Yang Maha Esa atas segala karunia dan ijinNya untuk membuat laporan kegitan tentang Daya Hantar Listrik Larutan. Dan tak lupa pula saya ucapkan terima kasih kepada guru kimia kelas x Akselerasi ibu Sri Meinarti, S.Pd.
Selain itu , saya ingin mengucapkan terima kasih kepada pihak-pihak yang telah membantu saya dalam pembuatan karya ilmiah ini, diantaranya :
1.Kedua orang tua saya yang telah menyemangati dan membimbing saya dalam karya tulis ini.
2.Teman-teman saya yang telah memberikan kritik dan saran dalam pembuatan karya ilmiah ini.
Saya pun menyadari bahwa karya ilmiah yang saya buat ini tidaklah sempurna. Oleh karana itu, saya meminta maaf yang sebesar-besarnya bila terdapat hal-hal yang salah dalam karya ilmiah yang saya buat ini.
Saya berharap bahwa karya ilmiah yang saya buat ini dapat membantu para pembaca sekalian. Akhir kata saya ucapkan terima kasih.
Daya Hantar Listrik Larutan
1. Tujuan
2.Alat dan Bahan :
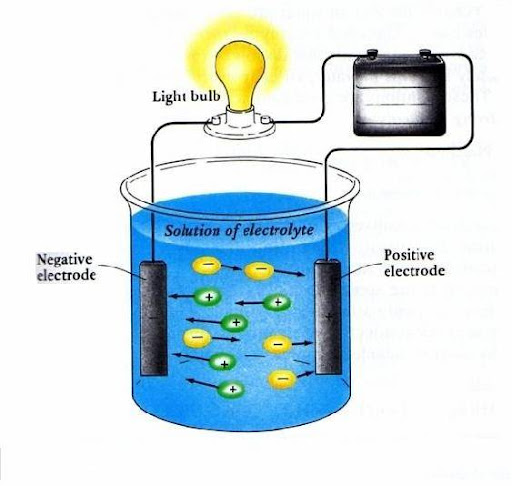
1. Power Supply/batu baterai( sumber energy)
2. Kabel penghantar
3. Lampu
4. adalah elektrode
5. Gelas Kimia berisi larutan sebagai berikut :
*Air suling
*Larutan gula
* Asam asetat
* Larutan amania
* Asam sulfat
* Asam klorida
* Natrium klorida
* Larutan NaOH
3.Cara kerja
1.Susunlah alat penguji elektrolit sehingga berfungsi dengan baik.
2.Masukkan + 50mL air suling ke dalam gelas kimia, kemudian uji daya hantarnya.
3.Bersihkan electrode dengan air dan keringkan. Dengan cara yang sama, ujilah daya hantar larutan lain yang tersedia, seperti :
1.Air suling
2.Larutan gula
3.Asam asetat
4.Larutan amania
5.Asam sulfat
6.Asam klorida
7.Natrium klorida
8.Larutan NaOH
4.Landasan Teori
5. Hasil Pengamatan
Tabel 1 Pengamatan
| Bahan Uji | Rumus Zat Terlarut | Reaksi Pada Elektrode | Reaksi Pada Lampu |
| Air Suling | H2O | Tidak Ada | Tidak Menyala |
| Larutan Gula | C12H22O11 | Tidak Ada | Tidak Menyala |
| Asam Asetat | CH3COOH | Sedikit Bergelembung | Tidak Menyala |
| Larutan Amonia | NH3 | Sedikit Begelembung | Tidak Menyala |
| Asam Sulfat | H2SO4 | Bergelembung | Menyala |
| Asam Klorida | HCl | Bergelembung | Menyala |
| Natrium Klorida | NaCl | Bergelembung | Menyala |
| Larutan NaOH | NaOH | Bergelembung | Menyala |
6.Pembahasan
Tabel 2 Gambaran bentuk elektrolit kuat, elektrolit lemah dan non elektrolit
| Jenis Larutan | Sifat dan Pengamatan Lain | Contoh Senyawa | Reaksi Ionisasi |
| Elektrolit Kuat | - terionisasi sempurna - menghantarkan arus listrik - lampu menyala terang - terdapat gelembung gas
| NaCl, HCl, NaOH dan H2SO4 | NaCl → Na+ + Cl- NaOH →Na+ + OH- H2SO4 →H+ + SO42-
HCl → H + + Cl- |
| Elektrolit Lemah | - terionisasi sebagian - menghantarkan arus listrik - lampu menyala redup bahkan tak menyala - terdapat gelembung gas | CH3COOH dan NH3 | CH3COOH →H++ CH3COO- -
|
| Non Elektrolit
| - tidak terionisasi - tidak menghantarkan arus listrik - lampu tidak menyala - tidak terdapat gelembung gas | Air Suling dan C12H22O11 | - - |
7.Kesimpulan
8.DAFTAR PUSTAKA
http://id.wikipedia.org/wiki/elektrolit
Purba,Michael. 2006. Kimia untuk SMA Kelas X Semester 1a . Jakarta:Erlangga.
Purba,Michael. 2006. Kimia untuk SMA Kelas X Semester 1b . Jakarta:Erlangga.

0 komentar:
Posting Komentar